Isozymy (allozymy)
Princip metody
molekule proteinu díky degeneraci genetického kódu neprojeví všechny změny ve struktuře DNA, lze obvykle najít enzymy, které: (a) jsou u studovaných organismů v různých jedincích/populacích/taxonech zastoupeny různými formami, které se liší pohyblivostí při elektroforéze a (b) a tyto rozdíly jsou dědičné. Při kombinaci dat z několika enzymů dohromady můžeme získat dostatečnou variabilitu pro odhad obvyklých populačně-genetických parametrů, studium rozdílů mezi taxony a nebo dokonce identifikaci jedinců (isozymová analýza se u rostlin často využívá k identifikaci jednotlivých klonů).
detekujeme vybraný enzym (resp. skupinu enzymů, enzymový systém). Využíváme tzv. histochemické barvení, při kterém detekujeme projevy reakce katalyzované zkoumaným enzymem – na gelu dostáváme v místě aktivity enzymu barevnou zónu. Detekce je u různých enzymů různě specifická – někdy dostáváme na gelu jednu zónu, označovanou jako lokus, která odpovídá jednomu enzymu pravděpodobně kódovanému jedním genem, častěji ale získáváme více lokusů. Přítomnost více lokusů může být způsobena dvěma faktory – buď je daný enzym v genomu kódován několika geny nezávisle (např. jednou v jádře a jednou v plastidech) nebo není naše detekce zcela specifická a jedním barvením detekujeme více různých enzymů najednou. Právě v počtu lokusů je rozdíl mezi pojmy isozymy a allozymy. Jako isozymy (isoenzymy) se označují všechny různé formy enzymu (ve smyslu různé pohyblivosti při elektroforéze), které detekujeme jednou barvící reakcí. Jako allozymy se označují pouze různé formy v rámci jednoho lokusu – tedy různé alely jednoho genu. Pojem isozymy je obecnější, allozymy jsou podmnožinou isozymů.
V současnosti je známo více než 100 specifických barvení (i když asi v žádné laboratoři není možné dělat všechny; u nás máme v současnosti materiál pro 21 enzymových systémů, rutinně používáme 10–12 z nich). Většina používaných enzymů patří mezi enzymy základního metabolismu (např. glykolýza, pentosafosfátový cyklus, Krebsův cyklus, metabolismus aminokyselin). To znamená, že tytéž enzymy zastoupeny u široké škály organismů a isozymová analýza je v tomto ohledu dosti univerzální metodou. Za druhé jsou enzymy (resp. geny je kódující) pod velkým selekčním tlakem – enzymy pro základní metabolismus musí v organismu fungovat. Proto lze předpokládat, že případné různé formy enzymů (tedy isozymy/allozymy) budou fungovat přibližně stejně, rozdíly budou ± selekčně neutrální. To je ideální stav pro výpočet populačně-genetických parametrů. (V současnosti ale víme, že tento předpoklad určitě neplatí stoprocentně).
Hlavními výhodami analýzy isozymů ve srovnání s DNA metodami je nižší cena, kodominantní charakter, takže je možné přímo rozlišit heterozygoty (z DNA metod má tuto vlastnost pouze analýza mikrosatelitů) a značná univerzálnost metody. Určitou výhodou je i menší náročnost na některé aspekty práce v laboratoři (menší riziko kontaminací, netřeba pracovat sterilně, pracuje se s většími objemy roztoků). Značnou nevýhodou je naopak nutnost izolovat isozymy z čerstvého živého materiálu. Určitou nevýhodou je i vyšší množství materiálu pro izolaci (problém u malých organismů, např. u mechorostů) a značná citlivost enzymů na teplotu a z toho vyplývající nároky na skladování a dostatečné chlazení při vlastní laboratorní práci. Pro interpretaci výsledků je také potřeba brát v úvahu, že ne všechny změny v kódující sekvenci DNA se projeví ve struktuře enzymu a ne všechny formy enzymu jsme schopni oddělit elektroforézou, takže analýza isozymů dává nižší odhady variability než je variabilita na úrovni sekvence DNA (odhady se pohybují mezi 20–60%).
Histochemické barvení
Barvicí roztoky mají tři hlavní součásti: (a) pufr udržující optimální podmínky pro daný enzym (určitá hodnota pH, u některých enzymů se přidává MgCl2, apod.), (b) substrát, který je specifický pro studovaný enzymový systém a je jeho činností metabolizován a (c) látky, které vytvářejí barevnou reakci.
Jsou tři hlavní způsoby detekce:
a) Přímá detekce. Dochází ke změně bezbarvého rozpustného substrátu na barevnou sraženinu, které se v gelu hromadí v místě aktivity enzymu a vytváří barevnou zónu.
b) Nepřímá detekce. Dochází ke změně barevného substrátu na bezbarvý produkt – gel je zbarvený, pouze v místě aktivity enzymu vznikají bezbarvé pruhy.
c) Spřažené reakce (využívané u naprosté většiny enzymových systémů). Produkt reakce není barevný, ale reakci je možné zviditelnit pomocí dalších souběžně probíhajících reakcí.
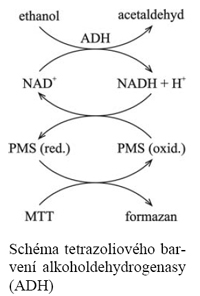
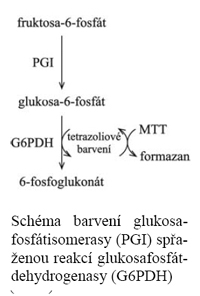 Typickým příkladem je tzv. tetrazoliový systém používaný pro detekci většiny dehydrogenáz – ty oxidují substrát a za účasti několika přenašečů se redukuje látka světle žlutá rozpustná tetrazoliová sůl MTT (thiazolyl blue tetrazolium bromide; thiazolylová modř) na modrofialový nerozpustný formazan, viz schéma. U některých systémů není ale možná ani podobná detekce pomocí spontánně probíhajících spřažených reakcí. V takovém případě se do barvícího roztoku přidává další enzym (někdy i více), který metabolizuje produkt námi zkoumaného enzymu, přičemž reakci tohoto druhého enzymu už obarvit schopni jsme – a protože substrát tohoto druhého enzymu v kaskádě je pouze tam, kde jej vyrábí první enzym, barevná reakce označuje polohu prvního enzymu v kaskádě, viz schéma. Schéma tetrazoliového bar-vení alkoholdehydrogenasy (ADH) Schéma barvení glukosa-fosfátisomerasy (PGI) spřa-ženou reakcí glukosafosfát-dehydrogenasy (G6PDH)
Typickým příkladem je tzv. tetrazoliový systém používaný pro detekci většiny dehydrogenáz – ty oxidují substrát a za účasti několika přenašečů se redukuje látka světle žlutá rozpustná tetrazoliová sůl MTT (thiazolyl blue tetrazolium bromide; thiazolylová modř) na modrofialový nerozpustný formazan, viz schéma. U některých systémů není ale možná ani podobná detekce pomocí spontánně probíhajících spřažených reakcí. V takovém případě se do barvícího roztoku přidává další enzym (někdy i více), který metabolizuje produkt námi zkoumaného enzymu, přičemž reakci tohoto druhého enzymu už obarvit schopni jsme – a protože substrát tohoto druhého enzymu v kaskádě je pouze tam, kde jej vyrábí první enzym, barevná reakce označuje polohu prvního enzymu v kaskádě, viz schéma. Schéma tetrazoliového bar-vení alkoholdehydrogenasy (ADH) Schéma barvení glukosa-fosfátisomerasy (PGI) spřa-ženou reakcí glukosafosfát-dehydrogenasy (G6PDH)
Histochemické barvení isozymů je poměrně citlivé na přesné dodržení reakčních podmínek (teplota, pH a koncentrace roztoků, někdy je nutné postupně doplňovat substrát). Používaná barviva většinou citlivá na světlo, takže příprava barvících roztoků a vlastní barvení musí probíhat ve tmě. Velmi důležitá je i správná délka barvení, kterou je třeba pro každý organismus a enzymový systém empiricky vyzkoušet – nesmí být ani příliš krátká (proužky slabé) ani příliš dlouhá (tzv. „přebarvení“, proužky jsou pak široké a neostré, může se zvýšit zabarvení pozadí gelu a proužky jsou pak málo zřetelné).
Základy interpretace isozymových patterns
Výsledkem analýzy isozymů je soustava proužků na gelu. Nejjednodušším vyhodnocením je pouhé porovnání pattern jednotlivých vzorků – shodují-li se genotypy (dané pozicí všech proužků) nebo ne. Takové jednoduché vyhodnocení je možné v některých případech použít, např. pro identifikaci klonů, ale obvykle nestačí. Pokud je to možné, snažíme se o tzv. alelické hodnocení – pokoušíme se najít, kolika alelami je daný lokus v studovaném souboru jedinců zastoupen, kteří jedinci jsou homozygotní a kteří heterozygotní, apod.
Pro alelické hodnocení je důležité znát kvartérní strukturu studovaného enzymu a ploidní úroveň zkoumaného organismu – haploid má vždy v jednom lokusu jedinou alelu (u rostlin se s tím lze setkat u mechorostů), diploid má u heterozygotů v jednom lokusu dvě alely, tetraploid dvě, tři nebo i čtyři, atd. Druhou podstatnou informací je kvartérní struktura studovaného enzymu.
Nejjednodušší situace je u monomerních enzymů, tj. enzymů, jejichž molekula je tvořena jediným proteinovým řetězcem, jedinou podjednotkou. V tomto případě odpovídá jeden proužek jedné alele – u homozygota bude vždy jeden, u heterozygota dva (u diploidů).
U dimerních enzymů složených ze dvou podjednotek tvoří u diploidů pattern buď jeden proužek u homozygotů nebo tři proužky u heterozygotů (u diploidů). Tři proužky u heterozygota vznikají tak, že krajní proužky odpovídají molekulám složeným ze dvou stejných podjednotek (jednoho nebo druhého typu) a prostřední proužek odpovídá molekulám složeným ze dvou různých podjednotek. Intenzita proužků je v ideálním případě 1:2:1 – nejčastěji se kombinují různé podjednotky, lze odvodit z jednoduché kombinatoriky. Podobně lze odvodit i stav pro složitější systémy (tetramery, hexamery, …).
U polyploidů počet proužků roste. I v nejjednodušším případě monomerního enzymu může mít heterozygot u tetraploida až čtyři proužky, v případě dimerů je to u tetraploida až deset proužků (při čtyřech různých alelách), u složitějších systémů ještě více. Takto složitá pattern už není obvykle možné alelicky přečíst („rozšifrovat“) a většinou se ani nedaří je obarvit – jsou zde velké rozdíly v intenzitě jednotlivých proužků, takže při dostatečném obarvení nejintenzivnějších jsou ty nejslabší nezřetelné a naopak dostatečné obarvení slabých proužků vede k přebarvení těch intenzivních.
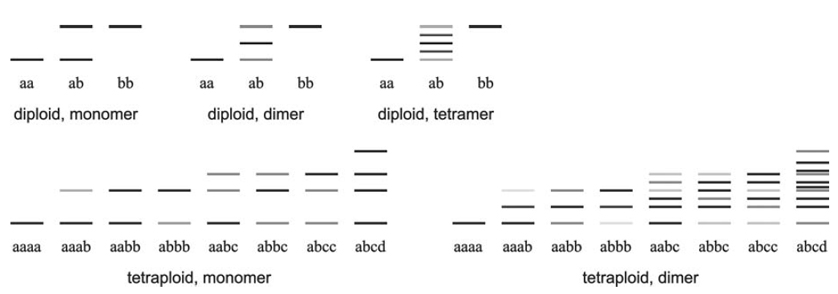
Příklady ideálních isozymových patterns, které se mohou vyskytnout u jednoho jedince určité ploidie a kvartérní struktury enzymu. U tetraploidů je zobrazen jen výběr ilustrující možné počty a intenzity proužků, ale ne všechny genotypy (analogicky budou vypadat např. bbbb, bbbc, aadd, atd.), vzájemné polohy jednotlivých alel mohou být samozřejmě jiné a u složitějších pattern se některé proužky mohou překrývat.
Interpretaci isozymových pattern mohou komplikovat i další faktory:
(a) Různá intenzita u různých jedinců. Rozdíly v celkové intenzitě barvení mezi jedinci většinou nelze brát v úvahu. Nemusí nesouviset s genetickými rozdíly, ale se způsobem zpracování vzorků, s rozdílným stavem, v jakém byly jednotlivé rostliny v době odběru nebo přesném množství izolovaného materiálu. Příliš rozdílná intenzita je problém při barvení, část jedinců bude nedobarvených nebo přebarvených a jejich pattern nečitelná, takové vzorky je obvykle nutné analyzovat znovu (a např. nanést na gel úměrně větší nebo menší množství extraktu). Někdy ale může mít intenzita (resp. až absence) barvení určitý význam, např. u jednoho taxonu se určitý lokus barví a u druhého ne.
(b) Sekundární proužky. U některých systémů se objevuje více proužků i u homozygotů. Tyto sekundární proužky mohou být nezřetelné nebo neostré („duchy“) nebo méně intenzívní, ale někdy jsou intenzitou nebo ostrostí srovnatelné se skutečnými „hlavními“ proužky. Mohou vznikat např. degradací enzymu, která vede k odlišné pohyblivosti při elektroforéze (přičemž ale i degradovaná molekula má nějakou enzymatickou aktivitu) nebo může jít o důsledek posttranslačních úprav.
(c) Nulové alely. Někdy se vyskytují formy enzymu, které nemají žádnou nebo téměř žádnou katalytickou aktivitu a v gelu se nebarví (jakoby tam nebyly). Obvykle nemohou být v homozygotním stavu (takový organismus by měl narušený základní metabolismus), ale mohou existovat u heterozygotů. U monomerních enzymů je není možné přímo odhalit (projevit se mohou ale mohou např. u analýzy kříženců, pokud pattern u potomstva „nesouhlasí“ s pattern rodičů). U dimerů se projevují tak, že (u diploidů) je pattern tvořeno dvěma proužky místo tří, přičemž heterodimerní („střední“) proužek je slabší. Analogicky to platí u složitějších systémů a nebo polyploidů.
(d) Intergenické (interlokusové) proužky. U enzymů složených z více podjednotek se mohou někdy skombinovat podjednotky z různých lokusů a vzniklá molekula je přesto funkční (i když je aktivita obvykle slabá). Může jít například o dvě kopie genu pro týž enzym, jednu jadernou a jednu z organel – v živé buňce se proteiny podle nich vytvořené asi nikdy nesetkají, ale v homogenátu pro isozymovou analýzu to možné je. V tomto případě nacházíme heterodimerní proužky i mezi lokusy.
Na začátek >>